2016年12月
歯周組織とインプラント周囲組織との違い(2)
歯周組織とインプラント周囲組織との構造的違いが、歯周病菌に対するバリアーとしての機能的な差につながると書いたが、今日は具体的に記述する。
インプラントと周囲粘膜は、「インプラント周囲上皮」と「インプラント周囲結合織」に分かれるのだが、天然歯の「歯肉上皮」と「上皮下結合織」に相当する。
まず、天然歯の「歯肉上皮」は、接着タンパクを介して歯と接着しているか、いないかで接着している「付着上皮」と接着していない「歯肉溝上皮」に分けられるのだが、「インプラント周囲上皮」も、インプラントと接着している「インプラント付着上皮」と「インプラント周囲溝上皮」に分けられる。前者が粘膜の根尖側の層で、後者が粘膜の入り口側の層だ。
ところで、天然歯の場合、健常な「歯肉上皮」には、1 セラミドとよばれる一種の脂質による生理学的な透過性関門 2 活発な細胞増殖による細胞交代(ターンオーバー) 3 接着タンパクによるシーリング(密封) 4 歯肉溝浸出液による滅菌・清掃の防御機能が備わっている。インプラント周囲上皮では、これらの防御機能が、果たして天然歯同様、備わっているのだろうか?
まず、セラミドによる生理学的透過性関門は、インプラント周囲上皮の外側(口腔側)には存在するが、内側(インプラント側)は非角化上皮からなるので存在しない。つまり、防御機能は存在しない。ちなみに、皮膚と同様口腔粘膜には,生理学的透過性関門という防御機構が備わっているため,外部からの水,細菌および毒素は生体内に侵入できないし,また内部の体液も外部に漏出することはない。口に含んだ水が粘膜内に侵入しないのは口腔粘膜上皮の細胞間隙にセラミドが存在し,透過性関門として働いているためと考えられる。
また、インプラント周囲上皮の防御能を知るために上皮細胞のターンオーバーの早さを調べる方法があるが、インプラント周囲上皮のターンオーバーは、天然歯の上皮細胞のそれの約3倍遅いことが知られている。これは、インプラント周囲上皮の防御機能が天然歯周囲上皮のそれよりも劣っていることを示している。臨床的には、インプラント患者のプラークコントロールは、天然歯だけの患者よりもより厳密におこなう必要があることを示唆している。
参考文献:三上 格,下野正基.基礎と臨床からみるインプラント治療後の維持管理. ザ・クインテッセンス. Vol.35. 48-67.2016
歯周組織とインプラント周囲組織との違い(1)
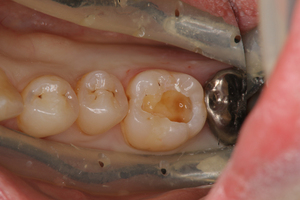
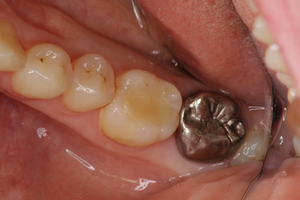
天然歯の歯周炎の管理は容易ではないが、インプラント周囲炎の管理はもっと容易ではない、という実感を持っている。両者とも歯周病菌の感染によって起こるので、歯周病菌の数が臨床症状を引き起こさないレベルにまでその数が減少していれば、歯周炎もインプラント周囲炎も起こらない。つまり、口腔清掃がパーフェクトであれば、歯周炎もインプラント周囲炎も絶対に起こらないのだ。しかし、現実には歯周炎は起こるし、インプラント周囲炎も起こる。それは、口腔清掃をパーフェクトに行うことなど、普通は出来ないからだ。いくら清掃しても、少々プラークは残るものだ。それでも臨床的に歯周炎にならないのは、少々の歯周病菌が歯周ポケットに残っていても、生体には歯周病菌に対する免疫力があるからなのだ。ところが、現実には、特に全身状態が低下していなくても歯周炎やインプラント周囲炎が発症する。同じ口腔でも、同様に清掃していたとしても、特定の歯やインプラントのみに歯周炎やインプラント周囲炎が発症する。これは、局所の問題なのだ。
もしも、特定の歯周ポケットやインプラント周囲ポケットのみにプラークが多量に付着していればその部位が歯周炎やインプラント周囲炎になる。しかし、プラークの残存がどの部位も一定レベルであれば、歯周炎やインプラント周囲炎になる部位には、局所の要因が存在する。
ところで、周囲の歯周病細菌数や免疫力が一定と仮定した場合、天然歯とインプラントでは、どちらが周囲に炎症を起こしやすいのだろうか?この問題を考えるには、天然歯の歯周組織とインプラント周囲組織との違いを理解するところから始めなければならない。
「歯周組織とインプラント周囲組織とはどこが違うのか?」を考えるとき、最も大きな違いはインプラントには「歯根膜がない」ことだ。歯根膜が存在しないということは、天然歯でみられる「セメント質ー歯根膜ー歯槽骨」という歯の結合様式がインプラントでは存在しないということだ。さらに、歯根膜に存在する神経や血管も存在しない。結局、インプラント体が生体内で接触している組織は、1 上皮組織 2 上皮下結合織 3 骨組織 ということになる。この歯周組織とインプラント周囲組織との構造の違いが、両者の細菌に対するバリアーとしての機能的な差を生み出している。
参考文献:三上 格,下野正基.基礎と臨床からみるインプラント治療後の維持管理. ザ・クインテッセンス. Vol.35. 48-67.2016
象牙質知覚過敏症(5)~なぜセラミックインレーやクラウンを入れるとしみるのか?~
セラミックインレーやクラウンを入れた後、なぜかしみる症状が出現した経験は多くの歯科医師が持っているだろう。今日はこの問題についてだ。
まず、健全象牙質を削ると「しみる」症状が出現する原因についてだが、以前に書いたように、齲蝕や咬耗を伴わない健全象牙質では、その内部の象牙細管は組織液で満たされている。この細管内の液体が、歯の表面に加わる刺激によって移動するので、細管内の知覚神経終末を刺激する結果、痛みが発生する。ちなみに、象牙細管内を液体が流れる速さは、秒速2~4mm程度であり、生活歯髄の歯髄内圧は15~30mmHgと報告されている。そして、歯髄内圧と外圧との差によって、象牙質壁1平方mmあたり5万~7万本存在する象牙細管では、細管圧の変動により、少なくとも一日100回は開口した細管が空になる可能性があるといわれている。
ところで、齲蝕や咬耗を伴う歯では、リン酸カルシウム系の結晶物が齲蝕の下方に存在しているので(透明層と呼ばれる)、齲蝕を削っても象牙細管は開口しない。つまり、結晶物で細管が封鎖されているのだ。しかし、健全象牙質を削ると、象牙細管はもろに露出する。セラミックインレーやクラウンは必ずしも齲蝕の存在する箇所以外の歯質を必然的に削るのだが、これにより、削られた健全歯質の表面に象牙細管が露出する。したがって、この露出した象牙細管を確実に封鎖できるか、出来ないかで、セラミックインレーやクラウンを装着したあとに不快症状が出現するか、しないかが決定する。セラミックスの修復物の装着は、接着性レジンセメントを使用するので、これと象牙質との界面に「ギャップのない」「密着性」を獲得できるか、否かがポイントとなる。
接着修復では必ず歯面の酸処理が要求されるため、象牙細管は必ず開口する。しかし、後続のレジン系材料がギャップなく密着適合すれば、刺激の伝達路は遮断され、歯髄刺激は発生しない。ところが、接着不全によりギャップが発生すると、辺縁微小漏えいにより歯髄刺激が惹起されたり、辺縁封鎖が良くても温度変化や咬合圧による歪みがギャップの容積変化を起こし、ポンピング作用による細管内組織液の移動により痛みが発生する。つまり、セラミックインレーやクラウン装着後のしみる症状は、接着不全が原因なのだ。ここに、接着の原理をしっかりと理解し、接着性レジンセメントを正しい術式で使用する必要があることの決定的根拠がある。修復材料がメタルからセラミックスへ移行しつつある現代歯科医学において、接着性レジンセメントの正しい使用法の理解は必須といえる。
参考文献:
冨士谷盛興・千田 彰.象牙質知覚過敏症 第2版.医歯薬出版.2013.
象牙質知覚過敏症(4)~炭酸ガスレーザーの知覚過敏に対する応用~
今日もしつこく象牙質知覚過敏症だ。ペリオや咬み合わせの臨床では日常的に遭遇するので、自分の臨床をブラッシュアップするためだ。
象牙質知覚過敏症にレーザーは有効だ。今日は特に当院にも置いているCO2レーザー(ヨシダOPELASER PRO)の知覚過敏に対する応用について書こう。
CO2レーザーは組織表面吸収型レーザーであり、知覚過敏に応用する際は、連続波(CW)の応用は避け、スーパーパルスモード・リピートモードを用いて歯表面の炭化、亀裂等を防ぐことを心がけねばならない(1)。レーザー単体で多くの症例で症状が消失あるいは減少するが、それでも薬剤の追加が必要な場合は、レーザー照射後に薬剤塗布する順番がいいだろう。レーザーは、知覚鈍麻や組織凝固、細管閉鎖の3つの効果が期待できるが、CO2レーザーは水に対する吸収効率が高いので、特に組織凝固により効果を発揮するからだ。レーザー照射後、細管封鎖の薬剤を塗布するのは理に適っている。
安定したCaF2の生成のため、CW Cont 0.6W またはSP1 RP 0.6W 100/300msecで照射する。尚、CW Cont とはContinuous Wave irradiation(連続波、連続照射)を、 SP1 RP 0.6W 100/300msec とは、 Super Pulse wave, Repeated Pulse irradiation (スーパーパルス波、繰り返し照射)のこと。SP1 は スーパーパルスモード1を、RPはリピート(繰り返し)照射モードを、0.6Wは照射出力を、100/300msecは分子の100が100msec(100/1000秒)の照射時間を、分母の300msecが300/1000秒の照射休止時間を表している(2)。また、1点に熱エネルギーが集中しないよう、必ずチップを動かしながら照射することが大切だ。
参考文献:
1 冨士谷盛興・千田 彰.象牙質知覚過敏症 第2版.医歯薬出版.2013.
2 改定版 SP搭載型CO2レーザー照射マニュアルチャート -31症例ー 第3版. 北九州レーザー研修センター 堀江和彦著. 2007.
象牙質知覚過敏症(3)~知覚過敏抑制剤の作用機序別一覧~
今日も象牙質知覚過敏症だ。臨床面で日常的に遭遇するものだし、薬剤の作用機序や物性を理解しておくことは重要だからだ。
今回は、知覚過敏抑制剤について、作用機序別に、網羅的に商品名を調べてみた。
まず「細管封鎖」だけを狙う薬剤だが、以下のものがある。
1 サホライド液歯科用38%(ビーブランド・メディコ-デンタル)
2 Fバニッシュ歯科用5%(ビーブランド・メディコ-デンタル()
3 スーパーシール5秒(モリムラ・エイコ―)
4 ナノシール(日本歯科薬品)
5 ティースメイトデセンシタイザー(クラレノリタケデンタル)
6 PRGバリアコート(松風)
7 G-ガード(ジーシー)
8 ハイブリッドコートⅡ(サンメディカル)
9 トクヤマシールドフォースプラス(トクヤマデンタル)
10 スコッチボンドユニバーサルアドヒーシブ(3M ESPE)
11 フジフィルLCフロー(ジーシー)
12 クリンプロXTバーニッシュ(3M ESPE)
13 フジⅦ(ジーシー)
14 MSコートONE(サンメディカル)
15 MSコートF(サンメディカル)
また、「知覚鈍麻」と「細管封鎖」の両方を同時に狙う以下の薬剤がある。
16 シュミテクトシリーズ (グラクソ・スミスクライン)
17 デンタ―システマしみるケア(ライオン)
18 スマートプロテクトソフト(茂久田商会)
19 システマセンシティブソフトペースト(ライオン)
20 ガム・デンタルジェルセンシティブ(サンスター)
21 メルサージュヒスケア(松風)
さらに、組織液の凝固を狙う薬剤として、以下のものがある。
22 グルーマ・ディセンシタイザー(へレウスクルツァー)
23 デセンシ―(日本歯科薬品)
参考文献:
冨士谷盛興・千田 彰.象牙質知覚過敏症 第2版.医歯薬出版.2013.
象牙質知覚過敏症(2)~その治療戦略~
さて、象牙質知覚過敏症の治療戦略は、1 象牙細管を封鎖する 2 知覚を鈍麻する 3 細管内組織液を凝固させる なのだが、その具体的方法について述べたい。
まず、一番目の象牙細管を封鎖する方法には、歯面に薬液を塗るだけの方法と、歯面に窩洞形成した後でセメント充填する方法がある。薬液を塗る方法は、歯面表層にカルシウム化合物を析出させることで細管入り口を封鎖するものだ。窩洞形成するものはグラスアイオノマーセメントやレジン系セメントで充填することで細管を封鎖する。この細管入り口を封鎖するものが、商品として最も多い。
二番目の知覚を鈍麻する方法として、まず薬液塗布がある。これは歯面表層でなくそれを細管内部に浸透させ、知覚神経終末を鈍麻させるものだ。この薬液としては硝酸カリウムを有効成分とする製品が一般的である。また、Nd:YAGレーザーや半導体レ―ザーは深部に到達するので、レーザーのLLLT効果を利用して感覚受容器の鈍麻を図る方法もある。ただし、レーザーの条件設定によっては歯髄組織や歯周組織に壊滅的ダメージを与えるリスクがあるので条件設定には慎重になる必要がある。
三番目の組織液を凝固させる方法としては、薬液を塗布して細管内に浸透させ、組織液を凝固させるものがある。この薬液に含まれている主成分は2つあり、一つは組織固定剤であるグルタールアルデヒド、もう一つは親水性モノマーであるハイドロキシエチルメタクリレート(HEMA)だ。接着性レジンのプライマーが歯肉につくと歯肉が白くなるが、これはHEMAなどの親水性モノマーのタンパク凝固作用によるもの。また、組織表面で吸収されるCO2レーザーを歯面に照射することでレーザーのエネルギーにより細管内組織液を凝固させる方法もある。この場合も、レーザー照射の条件設定を慎重にする必要があり、パワーが強すぎると歯質にダメージを加えるリスクがあるのはNd:YAGレーザーや半導体レ―ザーの場合と同じだ。
最後に、これは重要なことなのだが、上記の3つの方法を実施するには順番があり、先ず「鈍麻」、次に「凝固」、そして最後に「細管封鎖」の順でおこなうことが大切だ。最初から細管入り口を封じ込めてしまっては、内部に薬液を浸透させられなくなるからだ。実際の臨床では、一度の知覚過敏処置では効果が不十分なことがあり、その際、複数の知覚過敏抑制剤を選択する場合は、上記の順番を遵守することが鉄則なのだ。知覚過敏抑制剤の作用機序をよく理解しておかないと、無意味な処置を施してしまいかねないので要注意だ。
参考文献:
冨士谷盛興・千田 彰.象牙質知覚過敏症 第2版.医歯薬出版.2013.
象牙質知覚過敏症(1)~知覚過敏が起る理由~
今日のテーマは象牙質知覚過敏症だ。象牙質知覚過敏症とは、平たく言えば歯がしみる状態だ。日常の歯科臨床でよく遭遇するものの一つである。その対応において、なぜ知覚過敏が起るのかという原因に対する理解、そしてその治療法の選択にあたっては、治療材料の物性の理解が必須となる。歯科の特性として、硬組織の修復を使命としていることは事実であるので、どうしても修復に用いる材料の物性の理解、すなわち歯科理工学的な知識を持つことは避けて通れない。
今日は、一番基本の部分、すなわち、なぜ象牙質知覚過敏が起るのかという発生機序について調べてみた。現在、一般的に考えられているのは、「動水力学説」と呼ばれるものだ。すなわち、開口した象牙細管の細管内組織液がさまざまの刺激(たとえば甘いもの、冷たいもの、熱いもの、酸っぱいもの、などを採ること)により移動する。この液体の移動が、閾値が下がり敏感になった象牙細管内の神経終末や象牙芽細胞を興奮させて痛みが生じる、とする説だ。
知覚過敏を起こしている歯の過敏部位の象牙質は、その部位の象牙細管が歯の表面に開口しているのだが、細管レベルで歯髄と外界が交通し、食物(あんこやチョコレート、繊維質のもの)や、温熱、エアー、歯ブラシ、などが歯の表面を刺激し、象牙細管内の水分が移動することで、歯髄と象牙細管の移行部付近に存在する神経終末を刺激し、痛みとしての知覚が発生する。つまり、歯の表面の刺激は、象牙細管内の液体が動くことで、知覚神経終末に伝達されるわけだ。
そして、細管内の液体が動く理由は、細管が歯面に開口しているからだ。したがって、象牙質知覚過敏の治療戦略としては、
1 象牙細管口を封鎖する 2 知覚の閾値を上げる(感覚を鈍感にする) 3 細管内組織液内のたんぱく質を凝固させ、組織液を動かないようにする
以上の3つが治療戦略のターゲットとして浮かび上がって来る。
参考文献:
冨士谷盛興・千田 彰.象牙質知覚過敏症 第2版.医歯薬出版.2013.
歯に対する接着の基礎~エッチング、プライミング、ボンディングとは何か~
ワンステップボンドシステムは、シンプルゆえに臨床面で、テクニカルエラーを回避できる可能性が高い。しかし、弱点もある。その弱点は、ツーステップボンドと対比してみることで明確になるだろう。だから、今日のテーマは、エッチングとプライミング、そしてボンディングの役割を知ることだ。エッチングとプライミングの両者が合体しているセルフエッチングプライマーとボンディングを使用するのがツーステップボンドだからだ。
接着の最も基本の部分だが、被着体を天然歯とした場合、接着とはエッチング(脱灰)、プライミング(浸透)、ボンディング(硬化)の3つのステップで出来ている。エッチングとは酸でエナメル質や象牙質を侵食し、歯質表面をリアス式海岸のようにギザギザにすることだ。プライミングとはこのギザギザのザラ面の窪みに流動性の高いレジンモノマーを流し、ギザギザ面に馴染ませることだ。そしてボンディングとは、プライマー(レジンモノマー)で濡れたギザギザの入り江の表面に、さらにプライマーとは別の種類のボンディング(レジンモノマ)ーを流し込んで、光を照射し、プライマー(レジンモノマー)VS.ボンディング(レジンモノマー)を両者とも重合させ、それぞれのポリマー同士を絡みつかせることだ。
プライマー(レジンモノマー)がエナメル質や象牙質の歯面と強力にくっつく原理は、一つには凸凹内にはまり込んで機械的に篏合すること、もう一つはモノマーは歯質のハイドロキシアパタイト表面のCaにも化学的に強固に結合すること、の二つの理由による。
レジンはモノマーとポリマーの両方の状態をとりうる。重合したレジンはポリマーと呼ばれる同じ基本構造がいくつも連なった状態の有機高分子だが、重合する前は低分子のモノマーとして存在する。丁度、たんぱく質がアミノ酸という低分子が多くつながって高分子となっているようなものだ。アミノ酸がモノマーで、たんぱく質がポリマーに相当する。
プライマーもボンディングも、ともにレジンモノマーだが、プライマーは象牙質内のひだひだに深く入り込んで行かなければいけないので親水性(水を好む)である必要がある。なぜなら象牙質は細管構造を有しており、細管の中には液体が満たされているからだ。象牙質に深く入り込むモノマーが親水性でなければいけない理由は、象牙質は水気が多いからだ。そして、プライマーレジンとコンポジットレジンの両方に強固に結合しなければならないボンディングレジンは、疎水性(水を嫌う)である必要がある。レジンVS.レジンのポリマー同士が絡み合って架橋するのに水は邪魔だからだ。
今日では、エッチング、プライミング、ボンディングがそれぞれ別の溶液として販売されている、いわゆる3液性のシステムは少なくなっており、エッチングとプライマーが一つにまとめられているセルフアドヒーシブとボンディングの2液システムが現在では一般的だ。メガボンドはその代表例である。さらに、最近では、コンポジットレジン充填の前処置に必要な3液を一つの溶液に混ぜた形で売り出されており、これがユニバーサルアドヒーシブを用いる1液システムであり、ワンステップボンドシステムと呼ばれるものだ。このタイプの接着システムも、最近、増えてきている。疎水性モノマーと親水性モノマーが同一容器に入ってるわけだから、エアブローがテクニック上のポイントになることが容易に理解できる。モノマーを機能的に働かせるために加えられている水や有機溶媒を飛ばすのはエアブローだからだ。シリンジからのエアブローの加減一つで接着力が変化するということだ。
参考文献:
(1)原嶋郁郎、中林宣男、平澤 忠. レジンとレジンの接着.AD Vol.11 No.3.156-164.1993
(2) 猪越重久.1からわかるコンポジットレジン修復 レジンが簡単に取れないためのテクニック.クインテッセンス出版.東京.2012.
(3)宮崎真至.コンポジットレジン修復のサイエンス&テクニック.クインテッセンス出版.東京.2015.
ユニバーサルアドヒーシブ
先日、しみる症状を訴えて来られた患者さんの左下第一大臼歯のカリエスに、コンポジットレジン充填目的で窩洞を掘った。案外深かったので、充填後の知覚過敏を警戒し、コンポジットレジン充填の際、最近入手したユニバーサルアドヒーシブを塗布してからコンポジットレジンを充填してみた。当院の今までのレジン充填システムは、プライマーとして「メガボンド・プライマー」を塗布後、20秒待ってエアブローした後、ボンディングとして「メガボンド・ボンディング」をプライマーの上に塗布し、それから光照射していた。プライマーとボンディングの2液を使用する、いわゆる「2液性システム」だ。
最近、そのプライマーとボンディングを一つの液の中に混ぜて販売している「ユニバーサルアドヒーシブ」を入手したので、今回、使用してみた。結果は、しみる症状は全くとまった。今までの当院のレジン充填システムでは、時々、充填後、しみる症状が残ることがあったのだが、今回、それが全く消えてうれしい。この違いは、ユニバーサルアドヒーシブを応用したことよると思うので、今日のテーマはユニバーサルアドヒーシブだ。
ユニバーサルアドヒーシブは、ワンステップボンディング材。つまり、セルフエッチングプライマーとボンディング材の合材だ。使用方法の注意点は、以下の5点。
1 液(ボンディング材)は使用直前に用意する
2 最低1滴分は必ず用意する
3 窩洞全体にたっぷりと塗るか、新しい液を何度か塗り足すように塗布
4 エアブローは最初は中圧、次いで強圧でしっかりと行い、波打っていた液成分が動かなくなるまでおこなう
5 インジェクタブルレジンによるライニングは極力行う
使い方のコツがあるようだが、ワンステップで前処置が完了する点は非常に良い。シンプルイズベストであり、操作が一回で済むことでエラーの発生する確率が低下する。だから、これからはユニバーサルアドヒーシブを用いた接着性レジン修復をマスターしたい。
参考文献:冨士谷盛興.正しく使おうワンステップボンド、もっと使いこなそうインジェクタブルレジン.
日本歯科医師会雑誌.Vol.68.No.10.963-970.2016.
炭酸ガスレーザーをインプラントSLAサーフェイスに照射しても、レーザーはその生物学的適合性に影響しない
炭酸ガスレーザーは殺菌作用があるために、インプラント周囲炎を起こしているインプラント表面のデコンタミネーションを目的に、炭酸ガスレーザーをラフサーフェイスに照射するというアイデアが当然浮かんで来る。その際、レーザーの殺菌作用以外の物理学的作用がインプラント表面性状に影響しないことが前提となる。インプラント表面性状は、短い治癒期間でオッセオインテグレーションが得られるよう、各メーカーがしのぎを削って開発競争を行ってきただけに、各メーカーとも生物学的適合性が格段に向上している。生物学的適合性をわかり易く言えば、すんなり骨と馴染んで素早く骨と結合する性質のことだ。レーザー光線がインプラント表面のマイクロな形態的あるいは化学的性状を変化させれば、骨芽細胞のチタン表面へのノリが悪くなり、結果としてオッセオインテグレーションが遅れるのだが、これは困る。
SLA(Sandblasting Large grit and Acid etching)サーフェイスは、最も一般的で、代表的な生体適合性を向上させるための工夫を凝らして登場したインプラント表面性状である。当院で用いられているインプラントにもこの性状が備わっているが、炭酸ガスレーザー照射で生物学的適合性が変化しないか、気になっていたところだ。そんな折、炭酸ガスレーザー照射はインプラントSLAサーフェイスの生物学的適合性を変化しない、と報告した論文を見つけた。
それは、6.0Wというかなりの高出力の炭酸ガスレーザーをチタンディスクに照射し、そのディスク上に培養骨芽細胞を乗せて、その増殖スピードを対照と比較した実験報告だ。結果は、炭酸ガスレーザーは培養骨芽細胞のチタンディスクへの接着を阻害せず、増殖スピードにも影響しなかった。
レーザーは波長が長く大部分が水分に吸収されるため、インプラント表面温度はそれほど上がらない。照射しても熱が出ず、チタン表面の生物学的適合性に影響が及ばないとなれば、炭酸ガスレーザーはインプラント周囲炎のデコンタミネーションのツールとして有用といえそうだ。なんせ、レーザーはスイッチを入れて照射するだけ。だから、テクニック非依存的だ。そこがよいのだ。
参考文献
(1)J Lasers Med Sci. 2013 Spring;4(2):86-91.